TEORÍA DEL FLOGISTO
|
Si tuviéramos que decidir cuál es la ley o principio más importante en el campo de la Química no cabría ninguna duda, el
 principio de consevación de la masa o ley de Lavoisier. Y no por su complejidad, que no tiene ninguna, sino porque su establecimiento, a finales del siglo XVIII, marcó el nacimiento de la química moderna y el abandono de su predecesora, la alquimia. y por ello a su autor, el francés Antoine-Laurent Lavoisier ( 1743-1794) se le conoce como el padre de la química.
principio de consevación de la masa o ley de Lavoisier. Y no por su complejidad, que no tiene ninguna, sino porque su establecimiento, a finales del siglo XVIII, marcó el nacimiento de la química moderna y el abandono de su predecesora, la alquimia. y por ello a su autor, el francés Antoine-Laurent Lavoisier ( 1743-1794) se le conoce como el padre de la química.Se puede enunciar de distintas formas:
La materia ni se crea ni se destruye, sólo se transforma.
En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
En una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera.
Aunque te pueda parecer muy lógica y sensata esta idea, y que no tiene mucho mérito haber llegado a esa conclusión, Lavoisier tuvo que realizar numerosos y meticulosos experimentos para convencer a los que por entonces pensaban que al calentar un metal este ganaba masa cuando se convertía en una nueva sustancia. Lavoisier midió en un recipiente cerrado las masas del sólido y el aire antes y después de la combustión y llegó a la conclusión de que la masa que ganaba el metal era igual a la masa de aire que se perdía.
En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
En una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera.
Aunque te pueda parecer muy lógica y sensata esta idea, y que no tiene mucho mérito haber llegado a esa conclusión, Lavoisier tuvo que realizar numerosos y meticulosos experimentos para convencer a los que por entonces pensaban que al calentar un metal este ganaba masa cuando se convertía en una nueva sustancia. Lavoisier midió en un recipiente cerrado las masas del sólido y el aire antes y después de la combustión y llegó a la conclusión de que la masa que ganaba el metal era igual a la masa de aire que se perdía.
Aplicaciones de la Ley de Lavoisier
Cálculos en las reacciones químicas
A los químicos les interesa conocer la masa de reactivos que necesitan para obtener una cantidad de producto determinada en una reacción química, o la cantidad de producto que pueden obtener a partir de una determinada cantidad de reactivos. Los cálculos que hay que hacer para resolver estas cuestiones se llaman cálculos este quiométricos.
Para realizar los cálculos este quiométricos es necesario disponer de la ecuación química ajustada de la reacción.
Para realizar los cálculos este quiométricos es necesario disponer de la ecuación química ajustada de la reacción.
Por ejemplo en la siguiente reacción (síntesis de agua), el número de átomos de oxígenos de reactivos, es mayor al de productos.
H2 + O2 → H2O
Para igualar los átomos en ambos lados es necesario colocar coeficientes y de esta forma queda una ecuación balanceada.
2 H2 + O2 → 2 H2O
MASA ATOMICA
La masa atómica es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada. La masa atómica puede ser considerada como la masa total de protones y neutrones (pues la masa de los electrones en el átomo es prácticamente despreciable) en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica. La masa atómica está definida como la masa de un átomo, que sólo puede ser de un isotopo a la vez, y no es un promedio ponderado en las abundancias de los isotopos. En el caso de muchos elementos que tienen un isotopo dominante, la similitud/diferencia numérica real entre la masa atómica del isotopo más común y la masa atómica relativa o peso atómico estándar puede ser muy pequeña, tal que no afecta muchos cálculos bastos, pero tal error puede ser crítico cuando se consideran átomos individuales. Para elementos con más de un isótopo común, la diferencia puede llegar a ser de media unidad o más (por ejemplo, cloro). La masa atómica de un isótopo raro puede diferir de la masa atómica relativa o peso atómico estándar en varias unidades de masa.

MASA MOLECULAR
La masa molecular o masa molecular relativa es un número que indica cuántas veces la masa de una molécula de una sustancia es mayor que la unidad de masa molecular y sus elementos, se calcula sumando todas las masas atómicas de dicho elemento. Su valor numérico coincide con el de la masa molar, pero expresado en unidades de masa atómica en lugar de gramos/mol. La masa molecular alude una sola molécula, la masa molar corresponde a un mol (N = 6,022·1023) de moléculas.
CALCULO DE LA MASA MOLECULAR
masa molecular = masa atómica de A * n.º de átomos de A + masa atómica de B * n.º de átomos de B...
masa atómica del H: 1,00797 u, aproximadamente igual a (≈) 1 * n.º de átomos de H: 2 + masa atómica del O: 15,9994 u ≈ 16 * n.º de átomos de O: → 2 átomos de H x 1 átomo de O = 2 u + 16 u = 18 u.

REACCIÓN QUÍMICA
Tipos de Reacciones QuímicasMASA MOLECULAR
La masa molecular o masa molecular relativa es un número que indica cuántas veces la masa de una molécula de una sustancia es mayor que la unidad de masa molecular y sus elementos, se calcula sumando todas las masas atómicas de dicho elemento. Su valor numérico coincide con el de la masa molar, pero expresado en unidades de masa atómica en lugar de gramos/mol. La masa molecular alude una sola molécula, la masa molar corresponde a un mol (N = 6,022·1023) de moléculas.
CALCULO DE LA MASA MOLECULAR
La fórmula para calcularla es la siguiente:
hasta que no queden átomos diferentes.
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula. Así, en el caso del agua: H2O, su masa molecular es:
Si las cifras decimales son mayores que 0,5, el número másico se aproxima a la unidad entera siguiente. Ejemplo: el número másico del oxígeno es 15,9994 ≈ 16. Es decir, el número másico del O es 16.
Al igual que la masa atómica, la masa molecular se expresa en unidades de masa atómica: Umas (u) o daltons (Da), que son equivalentes. Los Da aportan la ventaja de poderse emplear para moléculas mayores al aceptar un múltiplo, el kilodalton: kDa.
La masa molecular se calcula de manera fácil sumando las masas atómicas. Por ejemplo la masa molecular del ácido sulfúrico:
H2SO4: H = 1,00797 Da; S = 32,065 Da; O = 15,9994 Da
H2 = 2 x 1,00797 Da = 2,01594 Da
S = 1 x 32,065 Da = 32,065 Da
O4 = 4 x 15,9994 Da = 63,9976 Da
Masa molecular = H2 + S + O4 = 2,01594 Da + 32,065 Da + 63,9976 Da = 98,07854 Da

REACCIÓN QUÍMICA
Una reacción química, cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o más sustancias (llamadas reactantes o "reactivos"), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de las reacciones se les denomina ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
Las reacciones químicas pueden clasificarse de manera sencilla en cinco grandes grupos. Existen otras clasificaciones, pero para predicción de los productos de una reacción, esta clasificación es la más útil.
Reacciones de Síntesis o Composición
En estas reacciones, dos o más elementos o compuestos se combinan, resultando en un solo
producto.
Síntesis Química: la combinación de dos o mas sustancias para formar un solo compuesto.
A + B à C
(donde A y B pueden ser elementos o compuestos)
|
Ejemplo:
Escriba la reacción de síntesis entre el aluminio y el oxígeno.
Solución:
Dos elementos se combinarán para formar el compuesto binario correspondiente. En este caso, el aluminio y el oxígeno formarán el óxido de aluminio. La ecuación que representa la reacción es la siguiente:
4 Al (s) + 3 O2 (g) à 2 Al2O3 (s)
Nota: Es importante recordar los elementos que son diatómicos, los cuales se escriben con un sub-índice de 2 cuando no se encuentran combinados y participan en una reacción. Estos son el hidrógeno, nitrógeno, oxígeno, flúor, cloro, bromo y el yodo.
Reacciones de Descomposición o Análisis
Estas reacciones son inversas a la síntesis y son aquellas en la cuales se forman dos o más productos a partir de un solo reactante, usualmente con la ayuda del calor o la electricidad.
Descomposición Química: la formación de dos o mas sustancias a partir de un solo compuesto.
A à B + C
(donde B y C pueden ser elementos o compuestos)
Ejemplo:
Escriba la ecuación que representa la descomposición del óxido de mercurio (II).
Solución:
Un compuesto binario se descompone en los elementos que lo conforman. En este caso, el óxido de mercurio (II) se descompone para formar los elementos mercurio y oxígeno. La ecuación que representa la reacción es la siguiente:
2 HgO (s) à 2 Hg (l) + O2 (g)
Estas reacciones son aquellas en las cuales un átomo toma el lugar de otro similar pero menos activo en un compuesto. En general, los metales reemplazan metales (o al hidrógeno de un ácido) y los no metales reemplazan no metales. La actividad de los metales es la siguiente, en orden de mayor actividad a menor actividad: Li, K, Na, Ba, Ca, Mg, Al, Zn, Fe, Cd, Ni, Sn, Pb, (H), Cu, Hg, Ag, Au. El orden de actividad de los no metales mas comunes es el siguiente: F, O, Cl, Br, I, siendo el flúor el más activo.
Desplazamiento Químico: un elemento reemplaza a otro similar y menos activo en un compuesto.
AB + C à CB + A ó AB + C à AC + B
(dónde C es un elemento más activo que un metal A o un no metal B)
|

Una reacción química es la manifestación de un cambio en la materia y la isla de un fenómeno químico. A su expresión gráfica se le da el nombre de ecuación química, en la cual, se expresan en la primera parte los reactivos y en la segunda los productos de la reacción.
A + B C + D
Reactivos Productos
Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.
Balanceo de ecuaciones por el método de Tanteo
El método de tanteo consiste en observar que cada miembro de la ecuación se tengan los átomos en la misma cantidad, recordando que en
H2SO4 hay 2 Hidrogenos 1 Azufre y 4 Oxigenos
5H2SO4 hay 10 Hidrógenos 5 azufres y 20 Oxígenos
Para equilibrar ecuaciones, solo se agregan coeficientes a las formulas que lo necesiten, pero no se cambian los subíndices.
Ejemplo: Balancear la siguiente ecuación
H2O + N2O5 NHO3
Aquí apreciamos que existen 2 Hidrógenos en el primer miembro (H2O). Para ello, con solo agregar un 2 al NHO3 queda balanceado el Hidrogeno.
H2O + N2O5 2 NHO3
Para el Nitrógeno, también queda equilibrado, pues tenemos dos Nitrógenos en el primer miembro (N2O5) y dos Nitrógenos en el segundo miembro (2 NHO3)
Para el Oxigeno en el agua (H2O) y 5 Oxígenos en el anhídrido nítrico (N2O5) nos dan un total de seis Oxígenos. Igual que (2 NHO3)
Otros ejemplos
HCl + Zn ZnCl2 H2
2HCl + Zn ZnCl2 H2
KClO3 KCl + O2
2 KClO3 2KCl + 3O2

REACTIVO
Un reactivo o reactante es, en química, toda sustancia que interactúa con otra en una reacción química y que da lugar a otras sustancias de propiedades, características y conformación distinta, denominadas productos de reacción o simplemente productos.
Por tratarse de compuestos químicos, los reactivos se pueden clasificar según muchas variables: propiedades físicoquímicas, re-actividad en reacciones químicas, características del uso del reactivo.
Sin embargo, por tratarse del concepto de reactivo la clasificación más adecuada en este caso sería la de características de su uso, según la cual se clasifican en el uso al que están destinados los reactivos. Esta clasificación viene dada en el envase del reactivo y depende del tratamiento que se le haya dado, de su riqueza, de su pureza que determina el uso químico que se le va a poder dar, teniendo en cuenta la precisión, exactitud y error absoluto que se ha de tener en la operación química a realizar.
Así los reactivos se pueden clasificar en:
- PB: Destinado a bioquímica.
- PA: Destinados a aplicaciones analíticas.
- QP: Químicamente puro, destinado a uso general en laboratorio.
- DC: Destinados a las aplicaciones del análisis clínico.
Que produce reacción. Substancia que se emplea en química para reconocer la naturaleza de ciertos cuerpos por medio de la acción que produce sobre ellos (es casi lo mismo que sustancia reactante).

PRODUCTO
Un producto es un conjunto de compuestos químicos (aunque en ocasiones sea uno solo) destinado a cumplir una función. Generalmente el que cumple la función principal es un solo componente, llamado componente activo. Los compuestos restantes o excipientes, son para llevar a las condiciones óptimas al componente activo (concentración, pH,densidad, viscosidad, etc.), darle mejor aspecto y aroma, cargas (para abaratar costos), etc.
Por "producto químico" se entiende toda sustancia, sola o en forma de mezcla o preparación, ya sea fabricada u obtenida de la naturaleza, excluidos los organismos vivos. Ello comprende las siguientes categorías plaguicida, (incluidas las formulaciones plaguicidas extremadamente peligrosas) y productos de la industria química.

REACTIVO LIMITANTE
El reactivo limitante es el reactivo que en una reacción química determinada, da a conocer o limita, la cantidad de producto formado, y provoca una concentración especifica o limitante a la anterior.
Cuando una ecuación está balanceada, la estequiometria se emplea para saber los moles de un producto obtenido a partir de un número conocido de moles de un reactivo. La relación de moles entre reactivo y producto se obtiene de la ecuación balanceada.
Generalmente cuando se efectúa una reacción química los reactivos no se encuentran en cantidades este quiometricamente exactas, es decir, en las proporciones que indica su ecuación balanceada. En consecuencia, algunos reactivos se consumen totalmente, mientras que otros son recuperados al finalizar la reacción. El reactivo que se consume en primer lugar es llamado reactivo limitante, ya que la cantidad de éste determina la cantidad total del producto formado. Cuando este reactivo se consume, la reacción se detiene. El o los reactivos que se consumen parcialmente son los reactivos en exceso.
La cantidad de producto que se obtiene cuando reacciona todo el reactivo limitante se denomina rendimiento teórico de la reacción.
El concepto de reactivo limitante, permite a los químicos asegurarse de que un reactivo, el más costoso, sea completamente consumido en el transcurso de una reacción, aprovechándose así al máximo.
METODO
Este método se basa en la comparación de la proporción de las cantidades de reactivo con la relación estequiometrico. Así, dada la ecuación general:
Siendo X e Y reactivos, Z productos y a, b y c, sus respectivos coeficientes estequiométricos.
Si
 <
< 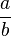 entonces X es el reactivo limitante.
entonces X es el reactivo limitante.
Si
 >
> 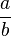 entonces Y es el reactivo limitante.
entonces Y es el reactivo limitante.Ejemplo
La ecuación balanceada para la oxidación del monóxido de carbono a dióxido de carbono es la siguiente:
Si se tienen 4 moles de monóxido de carbono y 3 moles de oxígeno, ¿cuál es el reactivo limitante?
Aplicando el procedimiento anterior tenemos que
 <
<  , por lo tanto CO es el reactivo limitante. En efecto, cuatro moles de CO sólo necesitan dos moles de O2para reaccionar, por lo que un mol de O2 quedará como exceso una vez finalizada la reacción.
, por lo tanto CO es el reactivo limitante. En efecto, cuatro moles de CO sólo necesitan dos moles de O2para reaccionar, por lo que un mol de O2 quedará como exceso una vez finalizada la reacción.
Este procedimiento puede hacerse extensivo a reacciones químicas con más de dos reactivos aplicando la fórmula:

para todos los reactivos. El reactivo con el cociente más bajo es el reactivo limitante.
Reactivo en exceso (R.E.)
Es aquella sustancia que ingresa al reactor químico en mayor proporción, por lo tanto queda como sobrante al finalizar la reacción.
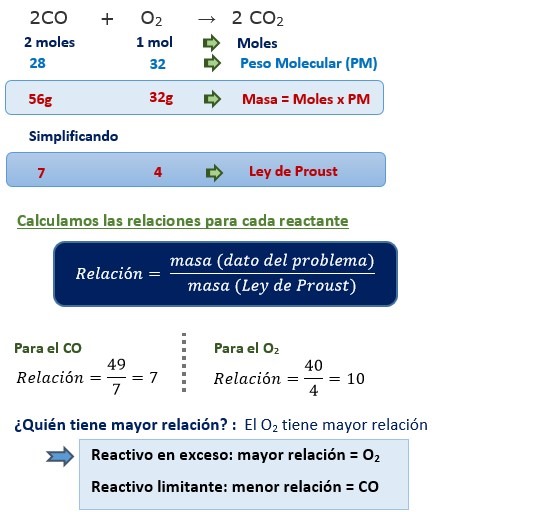
Ejercicio 1:
La combustión de monóxido de carbono (CO), produce dióxido de carbono (CO2) de acuerdo a la siguiente reacción. (P.A.: C=12 , O=16)
2 CO + O2 → 2CO2
Si reaccionan 49 gramos de CO y 40 gramos de O2 . Indicar quien es el reactivo en exceso y el reactivo limitante; además indicar que cantidad de reactivo en exceso existe.
Solución: Tenemos que hacer usar la ley de proporciones definidas (Proust).
% DE RENDIMIENTO DE UNA REACCIÓN
En química, el rendimiento, también referido como rendimiento químico y rendimiento de reacción, es la cantidad deproducto obtenido en una reacción química.1 El rendimiento absoluto puede ser dado como la masa en gramos o enmoles (rendimiento molar). El rendimiento fraccional o rendimiento relativo o rendimiento porcentual, que sirve para medir la efectividad de un procedimiento de síntesis, es calculado al dividir la cantidad de producto obtenido en moles por el rendimiento teórico en moles:

Para obtener el rendimiento porcentual, multiplíquese el rendimiento fraccional por 100% (por ejemplo, 0,673 = 67,3%).
Uno o más reactivos en una reacción química suelen ser usados en exceso. El rendimiento teórico es calculado basado en la cantidad molar del reactivo limitante, tomando en cuenta la estequiometría de la reacción. Para el cálculo, se suele asumir que hay una sola reacción involucrada.
El rendimiento teórico o ideal de una reacción química debería ser el 100%, un valor que es imposible alcanzar en la mayoría de puestas experimentales. De acuerdo con Vogel, los rendimientos cercanos al 100% son denominadoscuantitativos, los rendimientos sobre el 90% son denominados excelentes, los rendimientos sobre el 80% muy buenos, sobre el 70% son buenos, alrededor del 50% son regulares, y debajo del 40% son pobres.1 Los rendimientos parecen ser superiores al 100% cuando los productos son impuros. Los pasos de purificación siempre disminuyen el rendimiento, y los rendimientos reportados usualmente se refieren al rendimiento del producto final purificado.

QUE ES UN ÁTOMO
Un átomo es la unidad constituyente más pequeña de la materia que tiene las propiedades de un elemento químico.1 Cada sólido, líquido, gas y plasma se compone de átomos neutros o ionizados. Los átomos son muy pequeños; los tamaños típicos son alrededor de 100 pm (diez mil millonésima parte de un metro).2 No obstante, los átomos no tienen límites bien definidos y hay diferentes formas de definir su tamaño que dan valores diferentes pero cercanos.
Los átomos son lo suficientemente pequeños para que la física clásica dé resultados notablemente incorrectos. A través del desarrollo de la física, los modelos atómicos han incorporado principios cuánticos para explicar y predecir mejor su comportamiento.
Cada átomo se compone de un núcleo y uno o más electrones unidos al núcleo. El núcleo está compuesto de uno o más protones y típicamente un número similar deneutrones (ninguno en el hidrógeno-1). Los protones y los neutrones son llamadosnucleones. Más del 99,94 % de la masa del átomo está en el núcleo. Los protones tienen una carga eléctrica positiva, los electrones tienen una carga eléctrica negativa y los neutrones no tienen carga eléctrica. Si el número de protones y electrones son iguales, ese átomo es eléctricamente neutro. Si un átomo tiene más o menos electrones que protones, entonces tiene una carga global negativa o positiva, respectivamente, y se denomina ion.
Los electrones de un átomo son atraídos por los protones en un núcleo atómico por esta fuerza electromagnética. Los protones y los neutrones en el núcleo son atraídos el uno al otro por una fuerza diferente, la fuerza nuclear, que es generalmente más fuerte que la fuerza electromagnética que repele los protones cargados positivamente entre sí. Bajo ciertas circunstancias, la fuerza electromagnética repelente se vuelve más fuerte que la fuerza nuclear y los nucleones pueden ser expulsados del núcleo, dejando tras de sí un elemento diferente: desintegración nuclear que resulta entransmutación nuclear.

QUE ES MOLÉCULA
En química, se llama molécula a un conjunto de al menos dos átomos enlazados covalentes que forman un sistema estable y eléctricamente neutro.1 2
Casi toda la química orgánica y buena parte de la química inorgánica se ocupan de la síntesis y reactividad de moléculas ycompuestos moleculares. La química física y, especialmente, la química cuántica también estudian, cuantitativamente, en su caso, las propiedades y reactividad de las moléculas. La bioquímica está íntimamente relacionada con la biología molecular, ya que ambas estudian a los seres vivos a nivel molecular. El estudio de las interacciones específicas entre moléculas, incluyendo el reconocimiento molecular es el campo de estudio de la química supramolecular. Estas fuerzas explican las propiedades físicas como la solubilidad o el punto de ebullición de un compuesto molecular. Las moléculas rara vez se encuentran sin interacción entre ellas, salvo en gases enrarecidos y en los gases nobles. Así, pueden encontrarse en redes cristalinas, como el caso de las moléculas de H2O en el hielo o con interacciones intensas pero que cambian rápidamente de direccionalidad, como en el agua líquida. En orden creciente de intensidad, las fuerzas intermoleculares más relevantes son: las fuerzas de Van der Waals y los puentes de hidrógeno. La dinámica molecular es un método de simulación por computadora que utiliza estas fuerzas para tratar de explicar las propiedades de las moléculas.
¿QUÉ REPRESENTA EL NÚMERO DE AVOGADRO Y CUÁL ES SU VALOR?
El número de Avogadro es la cantidad de átomos, electrones, iones, moléculas que se encuentran en un mol, además este número sirve para establecer conversiones entre el gramo y la unidad de masa atómica.
La equivalencia del número de Avogadro es enorme, más o menos equivale al volumen de la luna dividido en bolas de 1 milímetro de radio.
El valor del número de Avogadro se halla a partir de la definición del número de átomos de carbono contenidos en 12 gramos de carbono-12 elevado a la potencia 23.
Ya en el año 2006, el Comité de Información para Ciencia y Tecnología recomendó que el valor del número de Avogrado sea el siguiente:
La equivalencia del número de Avogadro es enorme, más o menos equivale al volumen de la luna dividido en bolas de 1 milímetro de radio.
El valor del número de Avogadro se halla a partir de la definición del número de átomos de carbono contenidos en 12 gramos de carbono-12 elevado a la potencia 23.
Ya en el año 2006, el Comité de Información para Ciencia y Tecnología recomendó que el valor del número de Avogrado sea el siguiente:
Donde:
(30) es la incertidumbre estándar de la constante, concretamente al valor 0.000 000
30×1023 mol−1.
El número de Avogadro recibe ese nombre por el científico italiano Amedeo Avogadro, quien, dijo que el volumen de un gas es proporcional al número de átomos, o moléculas.
El valor del número de Avogadro donde se dice que equivale al diámetro medio de las moléculas en el aire por un método equivalente, fue propuesto por Johann Josef Loschmidt.
El número de moléculas en una molécula-gramo de oxígeno que para ser más exactos equivale a 32 gramos de oxígeno, es otra explicación que se tiene para definir el número de Avogadro, pero este número ya no es un número puro, sino es considerado más bien como una magnitud física.
También se puede definir el número de Avogadro en unidades como la libra-mol (lb-mol.) y el onza-mol (oz -mol.).
Por otra parte, el número de Avogadro, da la posibilidad de poder establecer conversiones entre el gramo y la unidad de masa atómica.
En resumen el número de Avogadro es el número de átomos o moléculas que existen en un mol de un elemento o compuesto, siendo su valor equivalente a 6.023×10(23) moléculas/mol. Para representarlo se usa el símbolo NA:
NA = 6.023·10(23) moléculas/mol




No hay comentarios:
Publicar un comentario